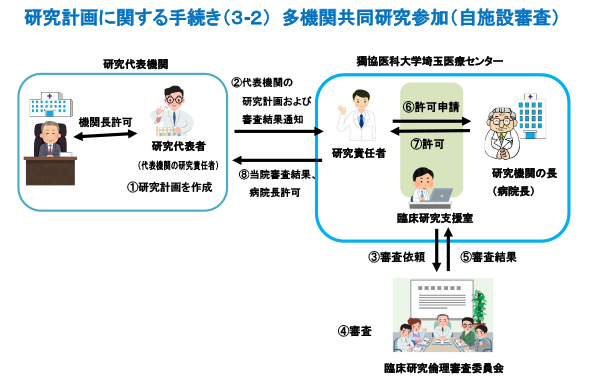
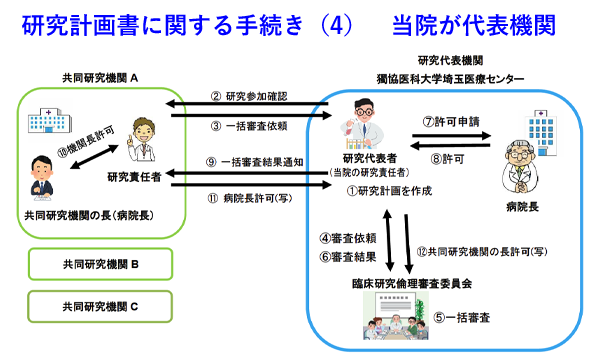
臨床研究について
人を対象とした生命科学・医学系研究に関する倫理指針
人を対象とした生命科学・医学系研究に関する倫理指針(厚生労働省) ![]()
獨協医科大学埼玉医療センター生命科学・医学系研究に関する手順書 ![]() [489KB]
[489KB]
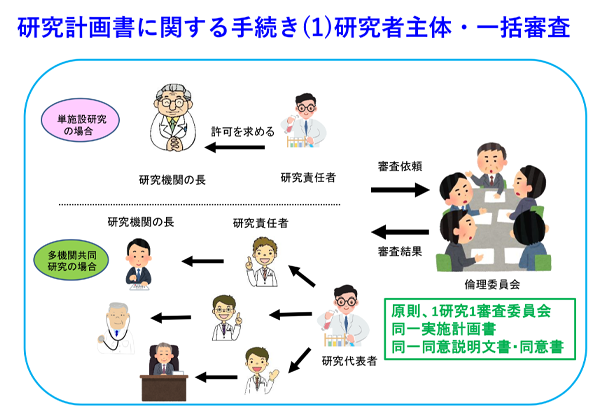
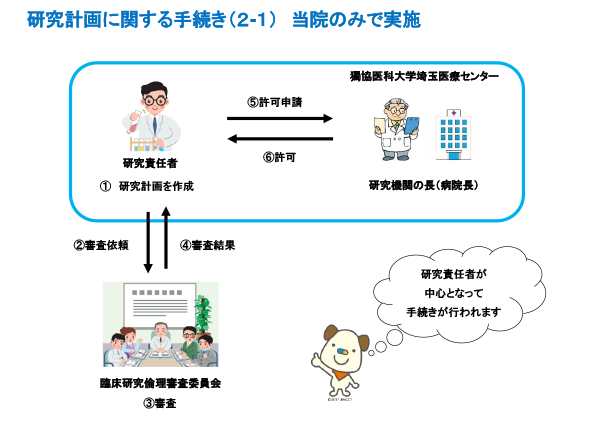
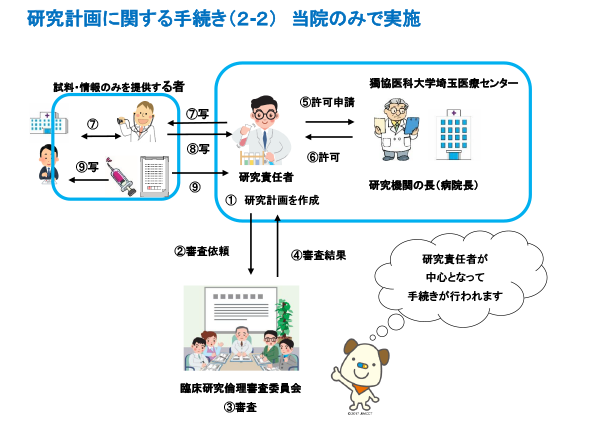
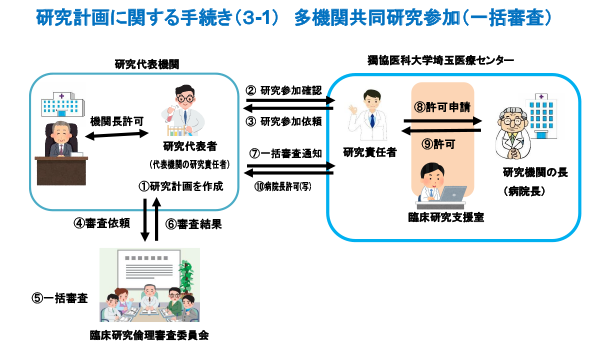
臨床研究実施の手続き
| 臨床試験 ・様式 |
様式名 | 記載方法 | ダウンロード | 備考 |
|---|---|---|---|---|
| 01-1 | 臨床研究新規審査依頼書 (審査用:B~E) | 申請時 | ||
| 01-2 | 臨床研究新規審査依頼書(迅速審査用:F~I) | 申請時 | ||
| 01-3 | 臨床研究新規審査依頼書(共同研究自機関迅速審査:J) | 申請時 | ||
| 02 | 臨床研究業務分担名簿(B~E) | 申請時 | ||
| 03 | 臨床研究の実施に係わる研究責任者の履歴書(B~E) | 申請時 | ||
| 契約書 | 申請時 (必要時) |
|||
| 研究実施計画書(B~E) | 申請時 | |||
| 同意説明文書・同意書(B~E) | 申請時 | |||
| 同意説明文書・同意書<軽微な侵襲用>(F-1) | 申請時 | |||
| 同意記録書(F-2,G) | 申請時 | |||
| 情報公開書(H,I) | 申請時 | |||
| 症例報告書(調査票)の見本 | 申請時 | |||
| 研究薬概要書(研究薬添付文書) | 申請時 | |||
| 04 | 臨床研究審査結果通知書 | |||
| 05 | 臨床研究許可申請書(一括審査用) | |||
| 06 | 臨床研究許可結果通知書(一括審査用) | 許可申請時 | ||
| 05/06 | 臨床研究確認,許可通知書(一括審査以外用) | |||
| 07 | 臨床研究倫理審査委員会委員出欠者名簿(04添付資料) | |||
| 08-1 | 臨床研究倫理審査委員会の指示事項への回答書 | |||
| 08-2 | 臨床研究倫理審査委員会の指示事項への回答確認書 | |||
| 09-1 | 臨床研究定期報告書(研究機関用) | 1回/年 | ||
| 09-2 | 臨床研究定期報告書(共同機関・既存試料提供者用) | 1回/年 | ||
| 10-1 | 臨床研究終了(中止・中断)報告書(研究機関用) | 終了時 | ||
| 10-2 | 臨床研究終了(中止・中断)報告書(共同機関・既存試料提供者用) | 終了時 | ||
| 11 | 臨床研究変更届 | |||
| 12 | 臨床研究による重篤な有害事象に関する報告書 | |||
| 13 | 新たな安全性情報に関する報告書 | |||
| 14 | 臨床研究実施計画書からの逸脱に関する報告書 | |||
| 15 | モニタリング・監査実施申請書 | |||
| 16 | モニタリング・監査実施承諾通知書 | |||
| 17-1 | データ入力業務申請書 | |||
| 17-2 | データ入力業務許可通知書 | |||
| 18 | 受託研究費請求書 | |||
| 19 | 納金連絡(臨床研究) | |||
| 参考 様式1-1 |
他の研究機関への試料・情報の提供に関する届出書(国内用) | |||
| 参考 様式1-2 |
他の研究機関への試料・情報の提供に関する届出書(国外用) | |||
| 参考 様式2 |
他の研究機関への試料・情報の提供に関する記録 | |||
| 参考 様式3 |
多機関共同研究一括審査調査票 | |||
| 参考 様式4 |
研究機関要件確認書 | |||
| CRCサポート体制 |
||||
| 臨床研究相談申し込み用紙 |
||||
| 利益相反自己申告書 | 学内サイト>教職員専用>医科大学>研究協力課>研究の実施に係る委員会>利益相反 | |||