資料作成は、文書中のコメントを必ずご確認ください。
ご作成された文書は、右上の [お問い合わせ] から電子版をお送りください。
ご作成された文書は、右上の [お問い合わせ] から電子版をお送りください。
新規審査
*「症例報告」等は「人を対象とする生命科学・医学系研究に関する倫理指針」で定める「研究」に該当しません【指針ガイダンスp.5 第2 注釈8参照】
| 様式1 | 臨床研究実施審査依頼書 | |
| 様式1-1 | 研究分担者・研究協力者リスト | |
| 特定臨床研究の該当性に関するチェックリスト |
研究計画書
| 多機関共同研究であり、既に準備されている研究計画書がある場合は、研究計画書の書きかえはせず、主機関の研究計画書のまま申請資料とし、 主機関における審査委員会の承認書の写しとともにご提出ください。 当機関のみ又は当機関が研究代表者として研究計画書を新たに作成される場合には、以下の案をご活用ください。 |
|
| 研究を目的として医薬品等を使用する研究 (適用内使用ではあるが、研究目的で医薬品等を使用する場合) |
|
| 研究目的とした医薬品等の使用はないが、新たに試料や情報の取得を行う研究 (医薬品等の使用は通常診療内であるが、通常診療では行わない試料採取や情報取得を行う場合) |
|
| 研究目的で治療や診断等を制御することなく、転帰や予後等に関する診療情報を収集する研究 (残余検体の利用や通常診療の医療記録を調査するものであり、研究としては既存試料・情報の利用にとどまる研究) |
|
| 研究計画書に添付するかたちで、必要な参考様式をお選びください。 | ||
| 参考様式1-1 | 他の研究機関への試料・情報の提供に関する(申請・報告)書 | |
| 参考様式1-2 | 日本国外にある機関への試料・情報の提供に関する(申請・報告)書 | |
| 参考様式2 | 他の研究機関への試料・情報の提供に関する報告書 | |
| 参考様式3 | 予測できない重篤な有害事象報告 | |
説明文書・同意文書等
| 多機関共同研究であり、既に準備されている文書がある場合は、以下の当機関用は使用せず、 主機関の文書のまま(word 版にて)ご提出ください。 |
||
| 研究を目的として医薬品等を使用する研究用の患者さん等への説明文書 (適用内使用ではあるが、研究目的で医薬品等を使用する場合) |
||
| 研究目的とした医薬品等の使用はないが、新たに試料や情報の取得を行う研究用の患者さん等への説明文書 (医薬品等の使用は通常診療内であるが、通常診療では行わない試料採取や情報取得を行う場合) |
||
| 研究目的で治療や診断等を制御することなく、転帰や予後等に関する診療情報を収集する研究用の情報公開文書 (残余検体の利用や通常診療の医療記録を調査する等であり、研究としては既存試料・情報の利用にとどまる研究) |
||
申請資料
下記の資料を不備のない内容で審査委員会開催の4週間前までに電子版でお送りください。
|
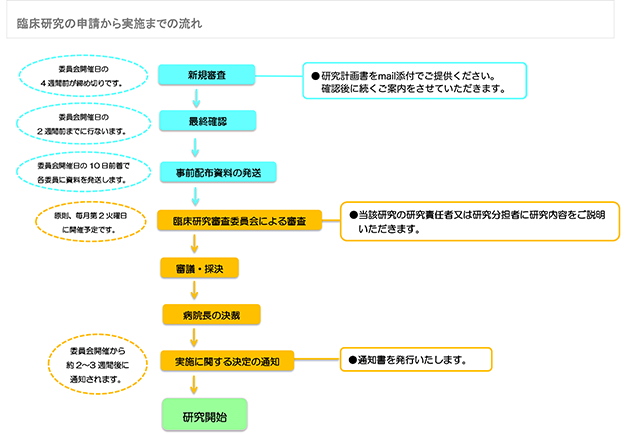
臨床研究の新規申請業務フロー
 クリックするとPDFが開きます。 |
