発生
腎芽腫(ウィルムス腫瘍)は5歳以下(75%は3歳以下)のこどもに発生する腎臓の腫瘍で、胎児期の後腎芽細胞を発生母地とすると考えられています。米国では1年間に500人の患者が発生し、100万人に7-8人の頻度で、小児腫瘍の6-8%をしめるといわれます。日本の統計では、年間登録数は約50例程です。5%の例では両側の腎臓に発生し、家族内発生も1%の例にみられます。
合併奇形・原因遺伝子
腎芽腫では5-12%の頻度で泌尿器などの先天奇形を合併することが知られています。無虹彩症、片側肥大、停留精巣、尿道下裂などをともなうことが多く、特に腎芽腫に無虹彩、泌尿生殖器奇形、精神発達遅延を合併したものをWAGR症候群、腎疾患、生殖器奇形を合併したものをDenys-Drash(デニス・ドラッシュ)症候群とよびます。また腎芽腫はからだの過成長や肥大をともなう症候群とも関連があり、これにはBeckwith-Wiedemann(ベックウィズ・ウィーデマン)症候群、Perlman(パールマン)症候群などがあります。1990年、腎芽腫に関連する遺伝子として11番染色体短腕(11p13)にあるがん抑制遺伝子WT-1が単離されました。WT-1は腎および泌尿生殖器の分化に関連し、転写調節因子として細胞増殖を制御しています。WT-1遺伝子は腎芽腫の原因遺伝子の一つと考えられていますが、WT-1遺伝子の異常をともなう腎芽腫の全体の10%以下です。Denys-Drash症候群ではWT-1遺伝子に変異があり、WAGR症候群ではWT-1遺伝子と近傍の無虹彩症原因遺伝子PAXの両者を含めた遺伝子座が欠失していることが知られています。一方、Beckwith-Wiedemann症候群では11番染色体短腕(11p15.5)に異常があり、この部位に第2の腎芽腫原因遺伝子の存在が想定されています。特にIGF2遺伝子は腎芽腫の一部で過剰発現しており、その有力な候補と考えられています。また家族性腎芽腫の原因遺伝子は17番、19番染色体の長腕にあるとも言われています。
診断
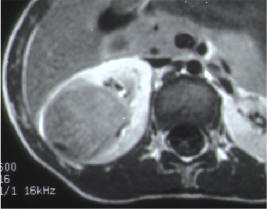
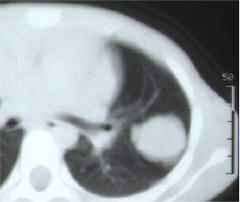
腹部のしこり(腫瘤)や腹痛、血尿で発見されることが多く、外傷をきっかけに発見されることもあります。 軽度の打撲でも腫瘍の膜が破れ、腫瘍内の出血や腹痛の原因になります。腎芽腫は肺や肝に転移しやすい特徴があります。腹部超音波検査、CT、MRIなどにより全身の検索を行い腫瘍の進展度、転移の有無を診断します。図は、右腎臓に発生した腎芽腫と肺転移の像を示します。
治療
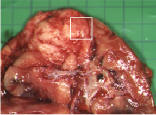
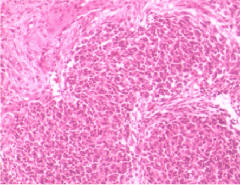
手術に化学療法や放射線療法を組み合わせた治療を行います。手術により切除した腫瘍の顕微鏡検査(病理検査)の結果により、悪性度の判定を行い、その後の治療内容を決定します。予後の良い組織型の場合、病期 I、IIでは腫瘍摘出後にアクチノマイシンD、ビンクリスチンなどを用いた化学療法を行います。病期III、IVでは腫瘍摘出後にアクチノマイシンD、ビンクリスチン、アドリアマイシンなどを用いた化学療法と放射線照射を行うのが一般的です。このような治療により腎芽腫の90%は治癒します。たとえ転移があっても予後良好型では80%前後の治療成績が得られています。図は、切除した腫瘍と病理検査の結果を示します。
両側性腎芽腫の治療
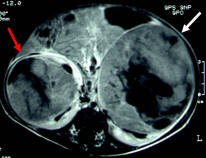
両側性の腎芽腫(病期V)では腎機能を温存するため、化学療法後に腫瘍摘出を行ったり、なるべく正常腎組織を残す腎温存手術などの高度な治療技術が必要となります。当施設では、腎温存手術を積極的に採用しています。図は、両側の腎臓に発生した腎芽腫(右赤矢印、左白矢印)をしまします。